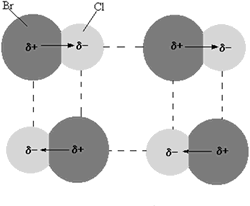
Óxido
En general, los óxidos se pueden sintetizar directamente mediante procesos de oxidación; por ejemplo, óxidos básicos con elementos metálicos (alcalinos, alcalinotérreos o metales de transición) como el magnesio:
2Mg + O2 → 2 MgO;
Un óxido básico es un compuesto que resulta de la combinación de un elemento metal con el oxígeno.
metal + oxígeno = óxido básico
Nomenclatura
Primero se escribe el nombre genérico del compuesto, que es óxido y al final el nombre del metal, esto es para metales con una valencia fija o única.
Ejemplo: óxido de sodio .
Fórmula: Siempre se escribe primero el símbolo del metal y después la del oxígeno Na2O el oxígeno siempre va a actuar con valencia -2.
Para nombrar a los óxidos básicos, se debe observar los números de oxidación, o valencias, de cada elemento. Hay tres tipos de nomenclatura: tradicional, por atomicidad y por numeral de Stock.
Propiedades De Los Óxidos
Óxidos: son compuestos binarios formados por la combinación del oxigeno con otro elemento.
• Estan unidos mediante un enlace iónico
• Los óxidos cuya función química es (O-2), siendo compuestos binarios se combinan con el agua para producir compuestos ternarios.
• Los óxidos metálicos producen bases de ahí el nombre alterno de óxidos básicos.
• Cuando un elemento se combina con el oxigeno, el producto resultante es un óxido.
• Se pueden crear óxidos mixtos, formados por dos elementos distintos y oxígeno.
• Se pueden crear óxidos binarios, formados por oxígeno y otro elemento distinto.
Bases o Hidróxidos
son compuestos ternarios que resultan de la combinación de algunos metales con agua o de un óxido básico con agua.
Las bases o hidróxidos se caracterizan, entre otras cosas, por tener sabor amargo, ser jabonosos al tacto, cambiar el papel tornasol de rosado a azul, ser buenos conductores de la electricidad en soluciones acuosas y ser corrosivos.
Propiedades de los Hidróxidos o Bases
• Crean sustancias que aceptan o reciben protones.
• Resultan de la combinación de un óxido básico con el agua.
• son sustancias que en solución producen iones de hidroxilo.
• son electrolitos (conducen la corriente eléctrica)
• los hidróxidos solubles en agua, cuando entran en contacto con ella, liberan aniones de hidroxilo.
• presentan un sabor amargo
• son cáusticos para la piel y para nuestro organismo.
Ácidos

Ácidos son compuestos que resultan de la combinación del hidrógeno con otro elemento o grupos de elementos de mucha electronegatividad y que se caracterizan por tener sabor ácido, reaccionar con el papel tornasol azul y tornarse rosado, generalmente producen quemaduras en la piel si se entra en contacto directo con ellos.
Los acidos se clasifican en Hidracidos y oxiacidos.
Los hidrácidos y los oxácidos se forman de la siguiente manera:
- Al reaccionar un no metal con el hidrogeno se forma un hidrácido.
Ejemplo: Cloro + Hidrogeno Acido Clorhídrico
Cl2 + H2 2HCl
- Al reaccionar un óxido ácido con agua se forma un oxácido.
Ejemplo: Trióxido de Azufre + Agua Acido Sulfúrico.
SO3 + H2O H2SO4.
Propiedades De Los Ácidos• Tienen sabor ácido como en el caso del ácido cítrico en la naranja y el limón.
• Cambian el color del papel tornasol azul a rosa, el anaranjado de metilo de anaranjado a rojo y deja incolora a la fenolftaleína.
• Son corrosivos.
• Producen quemaduras de la piel.
• Son buenos conductores de electricidad en disoluciones acuosas.
• Reaccionan con metales activos formando una sal e hidrógeno.
• Reaccionan con bases para formar una sal más agua.
• Reaccionan con óxidos metálicos para formar una sal más agua.
Sales
Son compuestos que resultan de la reacción de un acido con una base.
Formulación y nomenclatura:
Una sal haloidea, es decir, una sal que no contiene oxígeno se puede formar a través de reacciones como las siguientes:
- Ejemplo: Potasio + Cloro Cloruro de potasio2 k + Cl2 2HCl
- Al reaccionar un metal con un halógeno.Ejemplo: Magnesio + Ácido clorhídrico Cloruro de MagnesioMg + 2 HCl MgCl2 + H2
- Al reaccionar un metal activo con un hidrácido.Ejemplo: Ácido bromhídrico + Óxido metálico Bromuro de + aguaSodio2HBr + 2NaO 2 NaBr + H2O
- Al reaccionar un hidrácido con un óxido metálico.Ejemplo: Ácido clorhídrico + Hidróxido de sodio Cloruro de sodio + AguaHCl + NaOH NaCl + H2OUna oxisal, es decir, una sal que contiene oxígeno se puede formar así:
- Al reaccionar un hidrácido y un hidróxido (neutralización)Ejemplo: Magnesio + Ácido sulfúrico Sulfato de magnesio+ HidrógenoMg + H2SO4 MgSO4 + H2O
- Al reaccionar un metal activo con un oxácido.Ejemplo: Hidróxido de calcio + Dióxido de carbono Carbonato deCalcio + aguaCa(OH)2 + CO2 CaCO3 + H2O
- Al reaccionar un hidróxido con un anhídrido.
- Al reaccionar un hidróxido y un oxácido (neutralización)
Ejemplo: Ácido nítrico + hidróxido de bario Nitrato de
Bario + agua
2HNO3 + Ba(OH)2 Ba(NO3)2 + 2H2O
Propiedades de las Sales:

Las sales son por lo general sólido de sabor salado disoluciones acuosas conducen la corriente eléctrica. La mayoría no cambian el color del papel tornasol porque son sales neutras como el cloruro de sodio (NaCl) y nitrato de potasio (KNO3); no obstante, hay sales ácidas y básicas. Las sales ácidas forman disoluciones ácidas como en el caso del cloruro de aluminio (AlCl3) y cloruro de amonio (NH4Cl). Las sales básicas forman disoluciones básicas como en el caso del carbonato de sodio (Na2CO3) y cianuro de potasio (KCN).
Hecho por:
Laura Natalia Molina Vasquez
Wendy Yucely Delgadillo Blanco
grado:
10-1 T
Biblografia:
http://www.buenastareas.com/ensayos/%C3%93xidos-%C3%81cidos-Hidr%C3%B3xidos-Sales-Haloideas-Etc/3149141.html
http://www.buenastareas.com/ensayos/Propiedades-De-Los-Oxidos-Hidroxidos-Sales/5043225.html
http://www.monografias.com/trabajos21/compuestos-quimicos/compuestos-quimicos.shtml
http://www.rena.edu.ve/TerceraEtapa/Quimica/PropOxido.html