Fuerzas Intermoleculares
Las fuerzas intermoleculares, como su nombre lo indica, son las fuerzas que unen
moléculas. Ya deberías saber que no todas las sustancias forman moléculas. Existen tres tipos de
sustancias, iónicas, covalentes o metálicas según sea el tipo de unión que presentan. Las principales fuerzas intermoleculares son:
moléculas. Ya deberías saber que no todas las sustancias forman moléculas. Existen tres tipos de
sustancias, iónicas, covalentes o metálicas según sea el tipo de unión que presentan. Las principales fuerzas intermoleculares son:
- El enlace de hidrógeno (antiguamente conocido como puente de hidrógeno)
- Las fuerzas de Van der Waals, que podemos clasificar a su vez en:
- Dipolo - Dipolo.
- ion - Dipolo
- Dipolo - Dipolo inducido.
- Fuerzas de dispersión de London.
Fuerzas dipolo – dipolo o Fuerzas de dipolo permanente.
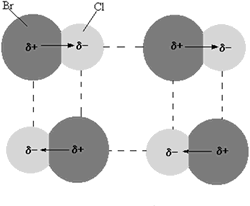
Cuando una molécula es un dipolo permanente se produce una atracción electrostática
entre el extremo positivo de una molécula y el extremo negativo de la molécula vecina. Esta es la
fuerza dipolo – dipolo.
En un líquido las moléculas están muy cercanas entre sí y se atraen por sus fuerzas intermoleculares. Las moléculas deben tener suficiente energía para vencer esas fuerzas de atracción, y hacer que el líquido pueda entrar en ebullición. Si se requiere más energía para vencer las atracciones de las moléculas del líquido A que aquéllas entre las moléculas del líquido B, el punto de ebullición de A es más alto que el de B. Recíprocamente, menores atracciones intermoleculares dan pie a puntos de ebullición más bajos.
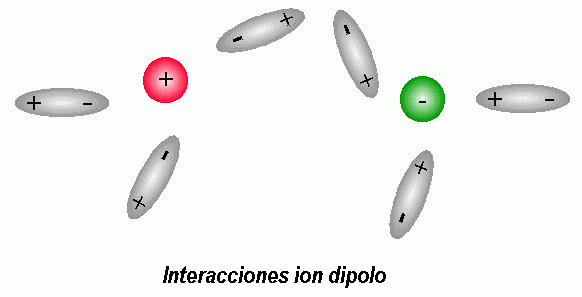
Fuerzas Ion - Dipolo
En un enlace polar, el átomo con mayor electronegatividad atrae los electrones hacia sí, generando un dipolo negativo en torno a sí mismo, mientras que se forma un dipolo positivo en el área del átomo con menor electronegatividad.
Fuerzas de London o dipolo temporario o dipolo
transitorio o dipolo inducido o fuerzas de dispersión.
Cuando una molécula es no polar, no existe un dipolo, su nube electrónica es simétrica.
Pero como los electrones están en continuo movimiento, puede suceder que momentáneamente se deforme y se produzca un dipolo. Esto puede suceder por choques entre moléculas o con las paredes del recipiente. Se dice que la molécula se polariza, y cuando esto sucede en una molécula, inmediatamente induce a la molécula vecina a que también se polarice. Continuamente entonces se están formando y destruyendo estos dipolos temporarios. Cuanto mayor es esa nube electrónica es más fácilmente polarizable y mayor es la fuerza de London. Esto también puede verse por la definición de momento dipolar μ = q . d. Cuanto mayor es la distancia que puede separarse esa fracción de carga, mayor es el momento dipolar de ese dipolo temporario de la fuerza de London y mayor es la fuerza de London. El tamaño generalmente (pero no siempre) está
asociado a una mayor masa molecular.
Esos corrimientos momentáneos de la nube electrónica se van a producir también en las
moléculas polares.
Uniones puente hidrógeno.
El puente de hidrógeno es un enlace que se establece entre moléculas capaces de generar cargas parciales. El agua, es la sustancia en donde los puentes de hidrógeno son más efectivos, en su molécula, los electrones que intervienen en sus enlaces, están más cerca del oxígeno que de los hidrógenos y por esto se generan dos cargas parciales negativas en el extremo donde está el oxígeno y dos cargas parciales positivas en el extremo donde se encuentran los hidrógenos. La presencia de cargas parciales positivas y negativas hace que las moléculas de agua se comporten como imanes en los que las partes con carga parcial positiva atraen a las partes con cargas parciales negativas. De tal suerte que una sola molécula de agua puede unirse a otras 4 moléculas de agua a través de 4 puentes de hidrógeno. Esta característica es la que hace al agua un líquido muy especial.

Los puentes de Hidrógeno, se forman por átomos de Hidrógeno localizados entre átomos electronegativos. Cuando un átomo de Hidrógeno está unido covalentemente, a una átomo electronegativo, ej. Oxígeno o Nitrógeno, asume una densidad (d) de carga positiva, debido a la elevada electronegatividad del átomo vecino. Esta deficiencia parcial en electrones, hace a los átomos de Hidrógeno susceptibles de atracción por los electrones no compartidos en los átomos de Oxígeno o Nitrógeno
huy pero que lindo trabajo las felicito se les ve el esfuerzo.
ResponderEliminar